Qu’est-ce que la RWE et les RWD ?
La RWE, aussi appelée étude en vie réelle, est un type d’étude qui utilise et analyse des RWD (données de vie réelle). Elles permettent de générer des preuves en conditions réelles d’utilisation, et ainsi d’apporter des informations complémentaires aux essais cliniques. Par exemple, il est possible d’étudier l’efficacité et la tolérance d’un traitement dans la pratique courante, sur une large population et à long terme afin de confirmer et d’affiner les résultats obtenus lors d’un essai clinique. Ces études apportent de meilleures connaissances sur les maladies et les traitements et aident les autorités et les professionnels de santé à prendre de meilleures décisions pour une meilleure prise en charge des patients.
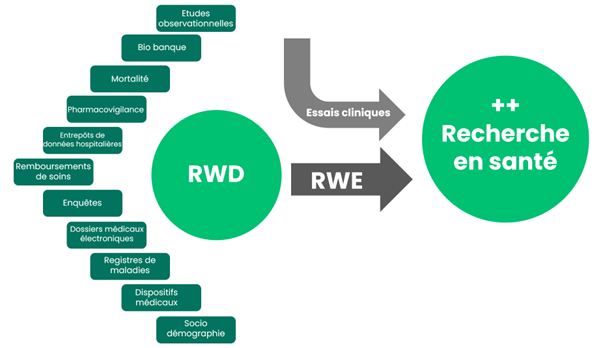
Quelles sont les RWD et comment sont-elles utilisées ?
Les données réelles proviennent de diverses sources, réparties entre données primaires et secondaires. Les données primaires, collectées de manière prospective sur le terrain, offrent une rigueur similaire à celle des essais cliniques, mais sont sujettes au biais de sélection. En revanche, les données secondaires, recueillies à des fins autres que la recherche initiale, sont plus représentatives de la population, bien qu’elles puissent manquer de standardisation.
Ces données comprennent une variété d’informations essentielles telles que les caractéristiques socio-démographiques, les diagnostics médicaux, les traitements prescrits et administrés, les résultats d’examens et bien plus encore. Lorsqu’une donnée clé fait défaut, les chercheurs peuvent effectuer un appariement avec d’autres sources pour enrichir leurs analyses.
Focus sur les données du SNDS en France
Le Système National des Données de Santé (SNDS) en France est bien plus qu’une simple base de données médico-administrative. Avec sa capacité à centraliser et à fournir des informations sur les remboursements médicaux en ville (DCIR), hospitaliers (PMSI) et les causes de décès (CépiDc de l’Inserm) pour près de 98% de la population, il ouvre un vaste champ d’exploration pour la recherche en santé. Ces données, en permettant des études basées sur des situations réelles, évitent les biais de sélection souvent présents dans les études classiques.
Cependant, exploiter le SNDS pour la recherche nécessite un processus rigoureux de contrôle et de validation pour assurer la fiabilité des résultats. Étant donné que la base ne contient pas de données cliniques directes, des algorithmes de ciblage sont nécessaires pour identifier les populations et les événements pertinents. De plus, l’enrichissement de la base avec d’autres sources de données, comme les registres, peut augmenter sa pertinence et sa valeur.
Grâce au SNDS, il devient possible d’estimer le nombre de patients touchés par une pathologie spécifique, tout en dressant des profils détaillés en termes d’âge, de sexe, de comorbidités et d’antécédents médicaux. En retraçant les parcours de soins, incluant les hospitalisations, les traitements et les suivis médicaux, ces données offrent une perspective globale et détaillée sur les dépenses de santé. De plus, elles documentent les transports médicaux, les arrêts de travail et les affections de longue durée, permettant une estimation précise du coût global de la prise en charge médicale, à la fois du point de vue de l’Assurance Maladie et par poste de dépenses.
Quels sont les avantages et défis des études RWE ?
1. Avantages
L’avantage majeur des études en vie réelle est d’obtenir des résultats complémentaires aux résultats des essais cliniques.
Tout d’abord, les études en vie réelle permettent d’obtenir des données pour tout type de patients, notamment chez les populations sous-représentées ou qui sont exclues des essais cliniques. Par exemple, les personnes de plus de 65 ans ou présentant des comorbidités importantes sont généralement exclues des essais cliniques, ce qui signifie qu’aucune donnée d’efficacité ou de tolérance n’est disponibles pour ces populations.
De plus, les données en vie réelle rendent possible la réalisation d’études sur des populations de taille plus importante que les essais cliniques, dont les tailles d’échantillons sont limitées par les critères de sélection. Elles permettent ainsi de détecter des événements rares ou de mettre en évidence des effets non-repérables dans les essais cliniques randomisés. Elles permettent aussi de vérifier la reproductibilité des résultats d’efficacité et de tolérance du traitement, dans une population plus large et moins « sélectionnée » que celle des essais cliniques.
Les RWD permettent également d’établir des constats dans des conditions de vie réelle. En conditions réelles d’utilisation, un patient peut oublier de prendre son traitement, prendre une double dose, prendre son traitement à des fréquences différentes de celles prévues et ces différentes situations peuvent affecter l’efficacité et la tolérance du médicament. Elles permettent aussi d’évaluer l’observance thérapeutique à un traitement et de la prendre en compte lors de son évaluation.
Les données fournissent généralement le recul nécessaire pour évaluer les effets d’un produit de santé à long terme. Par exemple, les données du SNDS permettent un suivi rétrospectif des patients sur près d’une quinzaine d’années. Conduire un essai clinique sur autant de temps pour observer des effets à long terme serait beaucoup trop coûteux et poserait des questions éthiques.
Malgré les autorisations nécessaires à l’utilisation des données, une étude en vie réelle est généralement plus facile, plus rapide et moins onéreuse à mettre en place qu’un essai clinique.
2. Défis
Cependant, malgré leurs avantages, les études en vie réelle présentent des défis substantiels. Contrairement aux essais cliniques contrôlés, les études en vie réelle évaluent principalement des associations plutôt que des causalités, les résultats doivent donc être interprétés avec précaution. De plus, des méthodologies rigoureuses doivent être utilisées pour se rapprocher de la rigueur des essais cliniques.
La qualité des données constitue également une préoccupation majeure, car certaines RWD sont collectées à des fins différentes de la recherche, ce qui peut entraîner des lacunes dans les informations nécessaires à l’analyse. De plus, les RWD sont souvent non structurées, hétérogènes et sujettes à des erreurs de mesure, nécessitant un nettoyage minutieux et des méthodologies adaptées, telles que le Machine Learning, pour atténuer les biais. Les techniques de Machine Learning sont de plus en plus populaires et sont des outils puissants pour la modélisation prédictive. L’une des raisons de leur popularité est que ces techniques sont tout à fait capables de traiter des données volumineuses, non structurées, et sans hypothèses fortes sur la distribution des données. Par exemple, le natural language processing (NLP), qui est un traitement automatique du langage naturel, peut être utilisé pour traiter les textes et les notes cliniques dans les dossiers médicaux électroniques et les transformer en données exploitables.
Sur le plan éthique, la protection des données personnelles est un défi constant, nécessitant une conformité stricte avec les réglementations telles que le RGPD (Règlement Général sur la Protection des Données). Assurer la transparence et le consentement des patients est crucial, tout en garantissant la sécurité et la confidentialité des données.
Quand et pourquoi utiliser la RWE ?
Sachant qu’il faut compter une bonne dizaine d’années pour développer un médicament, la RWE peut aider à différentes étapes du processus de développement.
Bien que les études pré-cliniques et les essais cliniques soient plus largement utilisés avant et pendant la phase de développement clinique d’un produit de santé, les études en vie réelle peuvent être utiles afin d’optimiser le protocole de l’essai clinique, réduire les coûts associés, réduire la durée de l’essai, soutenir les résultats obtenus et accélérer les prises de décisions réglementaires.
Le schéma ci-dessous détaille de nombreux exemples d’utilisation des RWE à chaque phase du développement d’un produit de santé.


Soline LEBLANC
Biostatisticienne IT&M STATS, Astek

Maeva MERLET
Responsable de la Division Interne IT&M STATS, Astek

Morgane BALLON
Biostatisticienne/Analyste IT&M STATS, Astek

